miércoles, 30 de noviembre de 2016
Datos del zinc para mas info
Los usos más importantes del zinc los constituyen las aleaciones y el recubrimiento protector de otros metales. El hierro o el acero recubiertos con zinc se denominan galvanizados, y esto puede hacerse por inmersión del artículo en zinc fundido (proceso de hot-dip), depositando zinc electrolíticamente sobre el artículo como un baño chapeado (electrogalvanizado), exponiendo el artículo a zinc en polvo cerca de su punto de fusión (sherardizing) o rociándolo con zinc fundido (metalizado).
El zinc es uno de los elementos menos comunes; se estima que forma parte de la corteza terrestre en un 0.0005-0.02%. Ocupa el lugar 25 en orden de abundancia entre los elementos. Su principal mineral es la blenda, marmatita o esfalerita de zinc, ZnS. Es un elemento esencial para el desarrollo de muchas clases de organismos vegetales y animales. La deficiencia de zinc en la dieta humana deteriora el crecimiento y la madurez y produce también anemia. La insulina es una proteína que contiene zinc. El zinc está presente en la mayor parte de los alimentos, especialmente en los que son ricos en proteínas. En promedio, el cuerpo humano contiene cerca de dos gramos de zinc.
El zinc puro y recientemente pulido es de color blanco azuloso, lustroso y moderadamente duro (2.5 en la escala de Mohs). El aire húmedo provoca su empañamiento superficial, haciendo que tenga color gris. El zinc puro es dúctil y maleable pudiéndose enrollar y tensar, pero cantidades pequeñas de otros metales como contaminantes pueden volverlo quebradizo. Se funde a 420ºC (788ºF) y hierve a 907ºC (1665ºF). Su densidad es 7.13 veces mayor que la del agua, ya que un pie cúbico (0.028m3) pesa 445 Ib (200 Kg).
El zinc es buen conductor del calor y la electricidad. Como conductor del calor, tiene una cuarta parte de la eficiencia de la plata. A 0.91ºK es un superconductor eléctrico. El zinc puro no es ferromagnético.
Es un metal químicamente activo. Puede encenderse con alguna dificultad produciendo una flama azul verdosa en el aire y liberando óxido de zinc en forma de humo. El zinc metálico en soluciones ácidas reacciona liberando hidrógeno para formar iones zinc, Zn2+. Se disuelve también en soluciones fuertemente alcalinas para formar iones dinegativos de tetrahidroxozincatos, Zn(OH)2-4, escrito algunas veces como ZnO2-2.en las fórmulas de los zincatos.
El zinc es siempre divalente en sus compuestos, excepto algunos cuando se une a otros metales, que se denominan aleaciones de zinc. Forma también muchos compuestos de coordinación. En la mayor parte de ellos la unidad estructural fundamental es un ion central de zinc, rodeado por cuatro grupos coordinados dispuestos espacialmente en las esquinas de un tetraedro regular.https://es.m.wikipedia.org/wiki/Wikipedia:Portada
Molaridad
1 M de Cl= 35.50 g
pero en este caso, se trata de cloro molecular, es decir que el compuesto esta así: Cl-Cl, y en este caso no tenemos una sola molécula de cloro, si no que son 2 por lo que
1M Cl= 71g
Entonces, si solamente estamos agregando 30 g de Cl cuántos moles son los que estamos agregando en 1 L de disolución? (recuerda que ese número de moles, los 71 g, es SÓLO para 1 L de disolución).
1M Cl= 71g
x = 30g
x=0.423 M
Ya tenemos el número de moles, pero resulta que esa cantidad es solamente cuando tenemos 1 L de solución, pero el problema nos pide que son 200 mL, así que:
1L = 0.423 M
0.2L = X2
X2= 0.085 M
En donde X2, es la res
Cloro
35,45
0,04
Masa atómica
https://es.m.wikipedia.org/wiki/Wikipedia:Portada
35,17
2,22
1,11
1
0,63
Masa molecular
17,59
1,97
0,14
martes, 29 de noviembre de 2016
cloro
Cloro |  |
Símbolo: Cl
Clasificación: Elementos halógenos Grupo 17 No metal
Número Atómico: 17
Masa Atómica: 35,4527
Número de protones/electrones: 17
Número de neutrones (Isótopo 35-Cl): 18
Estructura electrónica: [Ne] 3s2 3p5
Electrones en los niveles de energía: 2, 8, 7
Números de oxidación: -1, +1, +3, +5, +7
Electronegatividad: 3,16
Energía de ionización (kJ.mol-1): 1255
Afinidad electrónica (kJ.mol-1): 349
Radio atómico (pm): 99
Radio iónico (pm) (carga del ion): 181(-1)
Entalpía de fusión (kJ.mol-1): 3,205
Entalpía de vaporización (kJ.mol-1): 10,202
Punto de Fusión (ºC): -101,5
Punto de Ebullición (ºC): -34,04
Densidadg/m3): 3,214; (0 ºC)
Volumen atómico (cm3/mol): 23,53
Estructura cristalina: Ortorrómbica
Color: Amarillo-verdoso
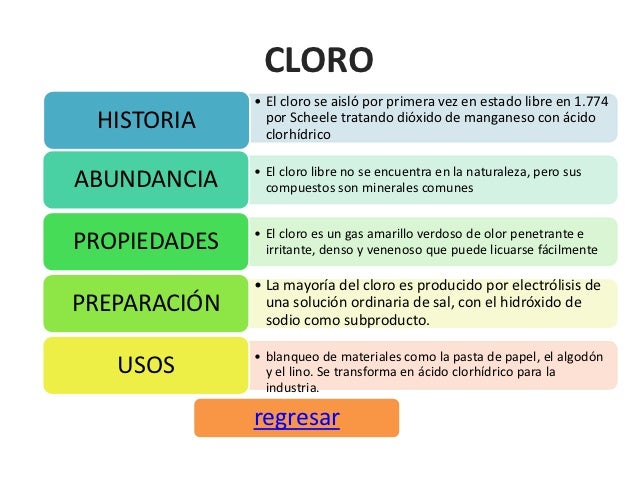
PROPIEDAD DE CLORO Y SU USO
cloro
Las propiedades químicas del cloro e información sobre el cloro y
otros elementos de la tabla periódica como flúor, bromo, azufre o argón.
También
aprenderás para qué sirve el cloro y conocerás cuales sus usos a través de sus
propiedades asociadas al cloro como su número atómico o el estado habitual en
el que se puede encontrar el cloro.

Propiedades de cloro
Los elementos del grupo de los halógenos como el cloro se
presentan como moléculas diatómicas químicamente activas. El nombre halógeno,
proviene del griego y su significado es "formador de sales". Son
elementos halógenos entre los que se encuentra el cloro, son oxidantes. Muchos
compuestos sintéticos orgánicos y algunos compuestos orgánicos naturales,
contienen elementos halógenos como el cloro. A este tipo de compuestos se los
conoce como compuestos halogenados.
El estado del cloro en su forma natural es
gaseoso (no magnético). El cloro es un elmento químico de aspecto amarillo
verdoso y pertenece al grupo de los halógenos. El número atómico del cloro es
17. El símbolo químico del cloro es Cl. El punto de fusión del cloro es de
171,6 grados Kelvin o de -100,55 grados celsius o grados centígrados. El punto
de ebullición del cloro es de 239,11 grados Kelvin o de -33,04 grados celsius o
grados centígrados
uso de cloro
Algunas moléculas que contienen cloro han sido responsables de
agotamiento del ozono. Si alguna vez te has preguntado para
qué sirve el cloro, a continuación tienes una lista de sus
posibles usos:
§ El cloro se utiliza (por lo general un
determinado compuesto de cloro) para matar las bacterias en las piscinas y en
el agua potable. También se utiliza en los
desinfectantes y blanqueadores por la misma razón. El cloro es muy efectivo
contra la bacteria E. coli.
§ Si bien no se utiliza tan a menudo hoy en día,
algunas fuerzas armadas aún usan el cloro como un gas venenoso. Es más
utilizado de esta forma normalmente por grupos terroristas.
§ El cloro se utiliza para fabricar plásticos.
§ El cloro se utiliza en la extracción de bromo.
§ El cloruro de metilo, otro compuesto importante
de cloro, se utiliza como un anestésico. También se utiliza para hacer ciertos
polímeros de silicona y se utiliza para extraer grasas, aceites y resinas.
§ El cloroformo, que contiene cloro, se utiliza
como un disolvente común en los laboratorios de ciencias. También se utiliza
para matar gusanos en las heridas de los animales.
§ El tricloroetileno se utiliza para desengrasar
piezas de metal.
SALES
En el lenguaje corriente,cuando hablamos de sal, nos referimos a la sal común de mesa cuyo nombre científico es cloruro de sodio; sin embargo son abundantes.Los compuestos que desde el punto de vista químico constituyen las sales.
LAS SALES SON COMPUESTOS IÓNICOS
Formados por aniones de ácido y cationes metálicos. A demás son compuestos ternarios que resultan de la reacción de un oxoácido y un hidróxido.
OXOÁCIDO + HIDRÓXIDO⇒SAL+H2O
Cinc. Cloro
Zn+ O⇒Zn O Cl+ 0⇒Cl O
²² ² ² ² ³
¹ ¹
ZnO+ H O⇒Zn(OH) Cl O + H O⇒ H Cl O
² ² ² ³ ²² ² ²
¹ ¹ ²
Zn(OH) + 2HClO ⇒ Zn(Cl2) + 2H O
² ² ²
LAS SALES SON COMPUESTOS IÓNICOS
Formados por aniones de ácido y cationes metálicos. A demás son compuestos ternarios que resultan de la reacción de un oxoácido y un hidróxido.
OXOÁCIDO + HIDRÓXIDO⇒SAL+H2O
Cinc. Cloro
Zn+ O⇒Zn O Cl+ 0⇒Cl O
²
¹ ¹
ZnO+ H O⇒Zn(OH) Cl O + H O⇒ H Cl O
² ² ² ³ ²
¹ ¹ ²
Zn(OH) + 2HClO ⇒ Zn(Cl2) + 2H O
² ² ²
domingo, 27 de noviembre de 2016
HIDRÓXIDO
Son compuestos ternales que resultan de la combinación de un óxido básico con agua.
ÓXIDO BÁSICO+AGUA=HIDRÓXIDO
ZnO + H2O➡Zn(OH)2
NOMENCLATURA DE STOCK:
Se nombra igual que los óxidos básicos pero reemplazando la palabra óxido por hidróxido
Ej:
Hidróxido de Zinc (II)
ÓXIDO BÁSICO+AGUA=HIDRÓXIDO
ZnO + H2O➡Zn(OH)2
NOMENCLATURA DE STOCK:
Se nombra igual que los óxidos básicos pero reemplazando la palabra óxido por hidróxido
Ej:
Hidróxido de Zinc (II)
NOMENCLATURAS DE ÓXIDOS BÁSICOS
Hay distintos tipos de nomenclaturas, serán dictadas a continuación:
NOMENCLATURA TRADICIONAL:
* Primero se coloca la palabra óxido.
*Luego el nombre del metal teniendo en cuenta el número de oxidación
1- Cuando tiene un número de oxidación, se antepone al nombre del metal la preposicional "de", en nuestro caso el óxido de zinc.
2-Cuando tiene dos números de oxidación, se añade al nombre del metal el sufijo "oso" para el número menor e "ico" para el mayor.
NOMENCLATURA DE ATOMICIDAD:
Teniendo en cuenta el el producto final:
Se indica por medio de prefijos griegos (mono,di,tri,tetra,pentra,hexa,hepta)el número de cada átomo que forma dicha molécula con la preposición de entre medio de los átomos.
Ej:
MONÓXIDO DE CINC
NOMENCLATURA DE NUMERAL STOCK:
*Primero se coloca la palabra "óxido".
*Seguido la preposición "de".
*Y por ultimo, el nombre del metal y entre paréntesis con número romano , el numero de oxidación que utiliza el metal.
Ej:
ÓXIDO DE ZINC (II)
NOMENCLATURA TRADICIONAL:
* Primero se coloca la palabra óxido.
*Luego el nombre del metal teniendo en cuenta el número de oxidación
1- Cuando tiene un número de oxidación, se antepone al nombre del metal la preposicional "de", en nuestro caso el óxido de zinc.
2-Cuando tiene dos números de oxidación, se añade al nombre del metal el sufijo "oso" para el número menor e "ico" para el mayor.
NOMENCLATURA DE ATOMICIDAD:
Teniendo en cuenta el el producto final:
Se indica por medio de prefijos griegos (mono,di,tri,tetra,pentra,hexa,hepta)el número de cada átomo que forma dicha molécula con la preposición de entre medio de los átomos.
Ej:
MONÓXIDO DE CINC
NOMENCLATURA DE NUMERAL STOCK:
*Primero se coloca la palabra "óxido".
*Seguido la preposición "de".
*Y por ultimo, el nombre del metal y entre paréntesis con número romano , el numero de oxidación que utiliza el metal.
Ej:
ÓXIDO DE ZINC (II)
OXIDACIÓN DEL ZINC
Los óxidos son productos que se obtienen de la combinación de los químicos con el oxígeno. si este no es un no metal resulta hacer un óxido ácido por el contrario si es un metal constituye un óxido básico.
METAL+OXÍGENO= ÓXIDO BÁSICO
NO METAL+OXÍGENO= ÓXIDO ÁCIDO
En el caso del Zinc es un óxido básico, por el motivo de que dicho elemento es un metal.
Para la formulación de este elemento hay una serie de pasos a seguir, como resultado obtenemos la siguiente formula:
Zn+O2➡Zn2O2
1 1
El nombre que obtiene este compuesto es, ÓXIDO DE ZINC, debido a que trabaja con un solo número de oxidación
PROPIEDADES Y USOS DEL ZINC:
Es un elemento químico con el símbolo Zn, tiene un numero atómico de 30 y peso atómico 65,37.
Es un metal maleable, dúctil, de color blanco azulado que arde en aire con llama verde azulada. presenta una gran resistencia a la deformación platica en frío que disminuye en caliente El zinc está presente de forma natural en las rocas, el suelo, el agua y el aire y es esencial para la salud y el bienestar de los seres vivos.
Los usos mas importantes los contribuyen las aleaciones y el recubrimiento de otros materiales. Por ejemplo, proteger el acero frente a la corrosión.
miércoles, 23 de noviembre de 2016
Suscribirse a:
Entradas (Atom)