Global 5° unico quimica
miércoles, 30 de noviembre de 2016
Datos del zinc para mas info
Los usos más importantes del zinc los constituyen las aleaciones y el recubrimiento protector de otros metales. El hierro o el acero recubiertos con zinc se denominan galvanizados, y esto puede hacerse por inmersión del artículo en zinc fundido (proceso de hot-dip), depositando zinc electrolíticamente sobre el artículo como un baño chapeado (electrogalvanizado), exponiendo el artículo a zinc en polvo cerca de su punto de fusión (sherardizing) o rociándolo con zinc fundido (metalizado).
El zinc es uno de los elementos menos comunes; se estima que forma parte de la corteza terrestre en un 0.0005-0.02%. Ocupa el lugar 25 en orden de abundancia entre los elementos. Su principal mineral es la blenda, marmatita o esfalerita de zinc, ZnS. Es un elemento esencial para el desarrollo de muchas clases de organismos vegetales y animales. La deficiencia de zinc en la dieta humana deteriora el crecimiento y la madurez y produce también anemia. La insulina es una proteína que contiene zinc. El zinc está presente en la mayor parte de los alimentos, especialmente en los que son ricos en proteínas. En promedio, el cuerpo humano contiene cerca de dos gramos de zinc.
El zinc puro y recientemente pulido es de color blanco azuloso, lustroso y moderadamente duro (2.5 en la escala de Mohs). El aire húmedo provoca su empañamiento superficial, haciendo que tenga color gris. El zinc puro es dúctil y maleable pudiéndose enrollar y tensar, pero cantidades pequeñas de otros metales como contaminantes pueden volverlo quebradizo. Se funde a 420ºC (788ºF) y hierve a 907ºC (1665ºF). Su densidad es 7.13 veces mayor que la del agua, ya que un pie cúbico (0.028m3) pesa 445 Ib (200 Kg).
El zinc es buen conductor del calor y la electricidad. Como conductor del calor, tiene una cuarta parte de la eficiencia de la plata. A 0.91ºK es un superconductor eléctrico. El zinc puro no es ferromagnético.
Es un metal químicamente activo. Puede encenderse con alguna dificultad produciendo una flama azul verdosa en el aire y liberando óxido de zinc en forma de humo. El zinc metálico en soluciones ácidas reacciona liberando hidrógeno para formar iones zinc, Zn2+. Se disuelve también en soluciones fuertemente alcalinas para formar iones dinegativos de tetrahidroxozincatos, Zn(OH)2-4, escrito algunas veces como ZnO2-2.en las fórmulas de los zincatos.
El zinc es siempre divalente en sus compuestos, excepto algunos cuando se une a otros metales, que se denominan aleaciones de zinc. Forma también muchos compuestos de coordinación. En la mayor parte de ellos la unidad estructural fundamental es un ion central de zinc, rodeado por cuatro grupos coordinados dispuestos espacialmente en las esquinas de un tetraedro regular.https://es.m.wikipedia.org/wiki/Wikipedia:Portada
Molaridad
1 M de Cl= 35.50 g
pero en este caso, se trata de cloro molecular, es decir que el compuesto esta así: Cl-Cl, y en este caso no tenemos una sola molécula de cloro, si no que son 2 por lo que
1M Cl= 71g
Entonces, si solamente estamos agregando 30 g de Cl cuántos moles son los que estamos agregando en 1 L de disolución? (recuerda que ese número de moles, los 71 g, es SÓLO para 1 L de disolución).
1M Cl= 71g
x = 30g
x=0.423 M
Ya tenemos el número de moles, pero resulta que esa cantidad es solamente cuando tenemos 1 L de solución, pero el problema nos pide que son 200 mL, así que:
1L = 0.423 M
0.2L = X2
X2= 0.085 M
En donde X2, es la res
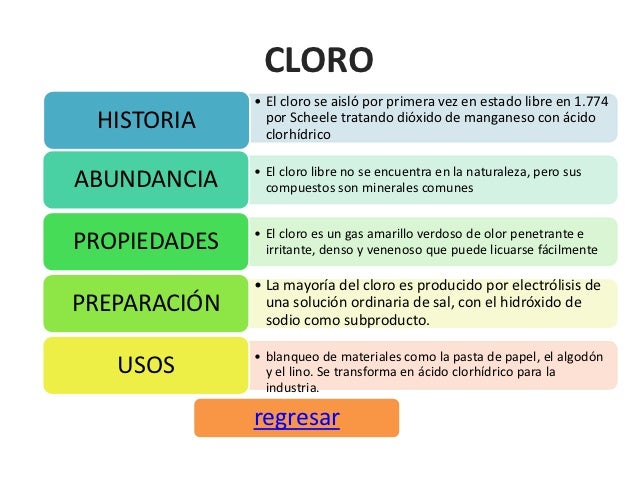
Cloro
35,45
0,04
Masa atómica
https://es.m.wikipedia.org/wiki/Wikipedia:Portada
35,17
2,22
1,11
1
0,63
Masa molecular
17,59
1,97
0,14
martes, 29 de noviembre de 2016
Suscribirse a:
Entradas (Atom)